Diabetes Typ 2: Diagnostik und moderne Ansätze zur Gesundheitsvorsorge
Derzeit sind in Deutschland mehr als 7 % aller erwachsener Bundesbürger wegen eines Typ-2-Diabetes in ärztlicher Behandlung. Dabei tragen neben einer genetischen Disposition vor allem die Ernährung und der Lebensstil entscheidend zur Entstehung von Diabetes Typ 2 bei. Insbesondere ein chronisch erhöhter Zuckerkonsum (Süßigkeiten, Lebensmittel, Getränke), Rauchen, Alkohol, Bewegungsmangel sowie Über- und/oder Fehlernährung sind Risikofaktoren einer Insulinresistenz, die bei 5 bis 10 % der Betroffenen zu einem Diabetes führt. Eine frühe Diagnose prädiabetischer Stadien ermöglicht es, die Krankheitsprogression und mögliche (Spät-)Folgen meist sogar ohne Einsatz von Medikamenten zu verhindern.
Die Ursachen einer Diabetesprogression sind in einer fortschreitenden Insulinresistenz, einer (zusätzlichen) Fehlfunktion der β-Zellen des Pankreas und in chronisch inflammatorischen Prozessen an den Gefäßwänden zu sehen. Dabei stellt die Insulinresistenz ein entscheidendes Bindeglied zwischen Typ-2-Diabetes und kardiovaskulären Komplikationen dar. Erstdiagnostizierte Diabetespatienten weisen in der Regel viele Begleitrisikofaktoren des Metabolischen Syndroms auf, wie z. B. Adipositas, arterielle Hypertonie und Dyslipidämie.
Neben den Parametern Blutglukose und HbA1c werden in zunehmendem Maße ergänzend die Biomarker Adiponektin, Insulin, Proinsulin und Leptin sowie inflammatorische Marker (CRP, PAI-1, TNF-α, IL-6 und IL-8) zur Diagnostik der Insulinresistenz und β-Zellfunktion der Bauchspeicheldrüse eingesetzt.
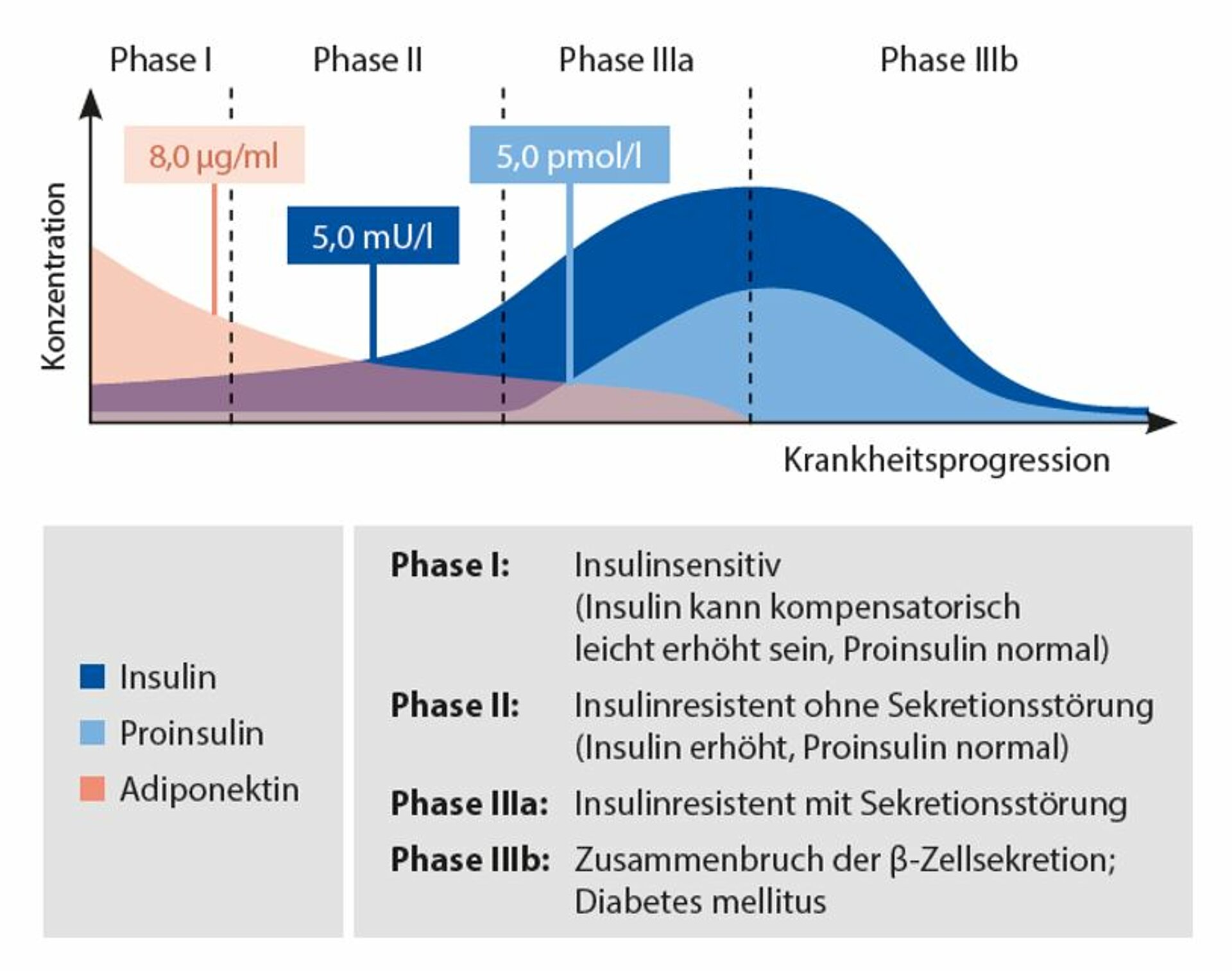
Die 3 Stadien des Prädiabetes
Die prädiabetische Phase wird in drei Stadien mit fließendem Übergang eingeteilt:
Stadium 1: Frühe Phase einer Insulinresistenz
Die frühe Phase einer Insulinresistenz ist in der Regel durch eine adäquate, kompensatorisch wirkende β-Zell-Tätigkeit des Pankreas charakterisiert. Die Nüchtern-Glukosewerte sind in diesem Stadium normal; die Nüchtern-Insulinspiegel in der Regel ebenfalls normwertig.
In diesem Stadium kann die Insulinsensitivität bereits allein durch diätetische Maßnahmen und Lifestyle-Änderungen verbessert und so eine Progression zu Stadium 2 verhindert werden.
Stadium 2: Phase der steigenden Insulinwerte
Das Stadium 2 ist durch eine gestörte Glukosetoleranz charakterisiert. In den meisten Fällen kann die kompensatorisch erhöhte Insulinsekretion eine Hyperglykämie verhindern. Bestehen jedoch schon erste Anzeichen einer beeinträchtigten β-Zellfunktion, wird ohne therapeutische Intervention eine Hyperglykämie folgen.
Im Stadium 2 können diätetische Maßnahmen und Lifestyle-Änderungen in Kombination mit einer Mikronährstoffsupplementierung, aber auch der Einsatz von oralen Antidiabetika wie Glitazone die Insulinsensitivität verbessern. Eine angemessene Glukoseregulation kann durch diese Maßnahmen wiederhergestellt und eine Progression in Stadium 3 verhindert werden.
Stadium 3: β-Zell-Dysfunktion
Im Stadium 3 kommt es zur Entwicklung des Diabetes mellitus Typ 2 durch eine fortschreitende Pankreas-β-Zellfunktionsstörung. Glukose- und HbA1c-Werte sind signifikant erhöht, Nüchtern-Insulinspiegel können je nach β-Zellfunktion der Bauchspeicheldrüse normal oder erhöht sein.
In diesem Stadium ist neben diätetischen Maßnahmen, Lifestyle-Änderungen sowie Mikronährstoffsubstitutionen auch eine gezielte pharmakologische Therapie notwendig.
Metabolische Marker des Prädiabetes
Adiponektin
Adiponektin ist ein Peptidhormon, welches ausschließlich in Fettzellen gebildet wird und zusammen mit Leptin, Insulin und anderen Hormonen das Hungergefühl reguliert. Es erhöht die Insulinempfindlichkeit in Fettzellen, der Leber und im Skelettmuskel und ist somit an der Regulation des Glukosestoffwechsels beteiligt.
Niedrige Adiponektinwerte treten bei Adipositas, Insulinresistenz und Typ-2-Diabetes-Patienten auf. Es besteht eine negative Korrelation zwischen dem Hormon und dem Auftreten von kardiovaskulären Risikofaktoren wie Hypertonie, Hypertriglyceridämie und niedrigen HDL-Cholesterinwerten sowie Entzündungsmarkern wie dem C-reaktiven Protein (CRP) und dem Fibrinolysemarker PAI-1. Studien belegen, dass eine konsequente Kalorienreduktion, Gewichtsabnahme und regelmäßige Bewegung niedrige Adiponektinspiegel anheben können.
Insulin
Insulin ist ein Hormon, das nach Stimulation durch Glukose in den β-Zellen der Bauchspeicheldrüse produziert wird. In Folge der Insulinausschüttung nehmen die Leber-, Fett- und Muskelzellen Glukose aus dem Blut auf. Darüber hinaus ist Insulin an der Speicherung von Glukose in Form von Glykogen in der Leber maßgeblich beteiligt, unterdrückt die hepatische Glukose-Synthese und verhindert den Fettabbau. Hohe Insulin-Werte werden mit einem erhöhten Diabetes-Risiko assoziiert.
Proinsulin
Proinsulin als Vorläufersubstanz des Insulins wird in den β-Zellen der Bauchspeicheldrüse produziert und gespeichert. Hier wird es bei Bedarf durch enzymvermittelte Abspaltung des C-Peptids in Insulin überführt. Aktives Insulin wird nachfolgend ins Blut freigegeben. Bei Gesunden finden sich nur geringe Mengen an intaktem Proinsulin im Blut.
Leptin
Leptin ist ein Proteohormon, welches hauptsächlich in Adipozyten, in geringeren Konzentrationen jedoch auch im Magenfundus, Skelettmuskel, in der Leber und Plazenta gebildet wird. Es besitzt eine Schlüsselrolle hinsichtlich der Regulation des Körpergewichts. Der Verlust der Leptinwirkung, möglicherweise durch eine Leptin-Transportstörung, führt zu einer Insulinresistenz. Hohe Leptin-Werte sind assoziiert mit einer pankreatischen β-Zelldysfunktion und einem erhöhten Risiko für Diabetes mellitus Typ 2.
Hämoglobin A1c (HbA1c)
Hämoglobin A1c beschreibt den prozentualen Anteil glykolysierter Hämoglobine am gesamten Hämoglobin. Es ist ein Maß für den durchschnittlichen Blutzuckerspiegel der vergangenen 6 – 12 Wochen. Dies entspricht etwa der Lebensdauer eines roten Blutkörperchens. Es sollte berücksichtigt werden, dass starke Schwankungen der Blutzuckerwerte durchaus einen normalen HbA1c-Wert vortäuschen können. Die Bestimmung glykierter Proteine wie HbA1c dient der Stoffwechselkontrolle von Diabetikern. Bei Stoffwechselgesunden liegt der Anteil an glykierten Hämoglobinen zwischen 4 und 6 %. Bei HbA1c-Werte > 7% liegt ein Diabetes mellitus vor.
Das Risiko kardiovaskulärer Erkrankungen ist eng mit der Höhe des HbA1c-Wertes assoziiert: Ein Anstieg des HbA1c-Wertes um 1 % erhöht das Risiko kardiovaskulärer Ereignisse oder die Sterblichkeitsrate um 20 -– 30 %.
HOMA-IR (Insulinresistenz)
HOMA-IR bedeutet „homeostatic model assessment-insulin resistance“ und dient dem Nachweis einer Insulinresistenz. Bei Diabetes mellitus kann ein falsch-normaler HOMA-IR-Index berechnet werden, wenn eine beeinträchtigte β-Zellfunktion eine stärkere Sekretion von Proinsulin im Nüchternzustand verursacht. Ein hoher HOMA-IR-Index kann einem Diabetes mellitus mehrere Jahre vorausgehen.
Zur Diagnostik der Risikoabschätzung für die Entstehung eines Typ-1-Diabetes besteht die Möglichkeit der Bestimmung von Antikörpern im Blut: GAB II-AK (Glutamatdecarboxylase-Antikörper), IA2-AK (Tyrosinphosphatase-Antikörper), ICA (Inselzellantikörper) und Insulin-AK (Insulinautoantikörper)
Wichtige Dokumente zu Diabetes mellitus
Downloads
- Erweiterte Prädiabetes-Diagnostik
- Anforderungsbogen B | Selbstzahler Herz-Kreislauf, Hormone, Neurohormone und Neurotransmitter
- Anforderungsbogen B | Privatpatient Herz-Kreislauf, Hormone, Neurohormone und Neurotransmitter
- Anforderungsbogen E | Selbstzahler Mitochondropathie, Stoffwechsel, Neurohormone und Neurotransmitter
- Anforderungsbogen E | Privatpatient Mitochondropathie, Stoffwechsel, Neurohormone und Neurotransmitter
- Alle anzeigen